Gesetzlicher Hinweis gemäß § 12 Abs. 2 und Abs. 3 Vermögensanlagengesetz: Der Erwerb dieser Vermögensanlage ist mit erheblichen Risiken verbunden und kann zum vollständigen Verlust des eingesetzten Vermögens führen. Der in Aussicht gestellte Ertrag ist nicht gewährleistet und kann auch niedriger ausfallen.
Investment Kennzahlen
Erklärungen zum Unternehmensprofil und Zinssatz – inkl. Renditerechner.Beschreibung
Beschreibung
- Kurzbeschreibung
- Team
- Produkt und Kundennutzen
- Innovation und Technologie
- Markt und Zielgruppe
- Wettbewerb und Alleinstellungsmerkmale
- Geschäftsmodell und Vertrieb
- Bisherige Erfolge
- Ziele und Kapitalverwendung
- Top Gründe für eine Investition
- Risikomanagement
- Über Dendropharm
- FAQ
- Due Diligence Datenraum
Kurzbeschreibung
Wir haben eine Nanotechnologie entwickelt, die ein weltweites Problem adressiert: Die Opiatkrise. Laut WHO starben 2019 rund 600.000 Menschen an den Folgen von Drogenkonsum – nahezu 80 % davon im Zusammenhang mit Opioiden. Ein zentraler Treiber dieser Krise ist die postoperative Schmerztherapie: Viele Abhängigkeiten beginnen direkt nach einem medizinischen Eingriff. Das darf – und muss – nicht sein.
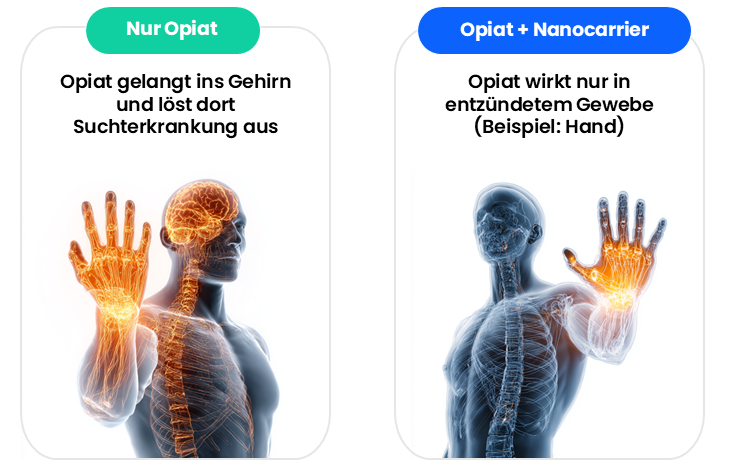
Unsere Lösung ist eine patentgeschützte Nano-Drug-Technologie, die Schmerzbehandlung neu definiert. Wir kombinieren bewährte, bereits zugelassene Wirkstoffe mit unserem Nanocarrier. Dieser mikroskopisch kleine Träger umhüllt den Wirkstoff (z.B. das Opioid) und transportiert ihn gezielt dorthin, wo er wirkt – etwa in entzündetes oder verletztes Gewebe.
Der entscheidende Vorteil: Der Wirkstoff gelangt dadurch nicht ins Gehirn. Damit sinkt das Risiko für Suchterkrankungen und typische Opiat-Nebenwirkungen wie Atemdepression, Übelkeit, Verstopfung, Sedierung und eine starke emotionale Distanzierung deutlich.
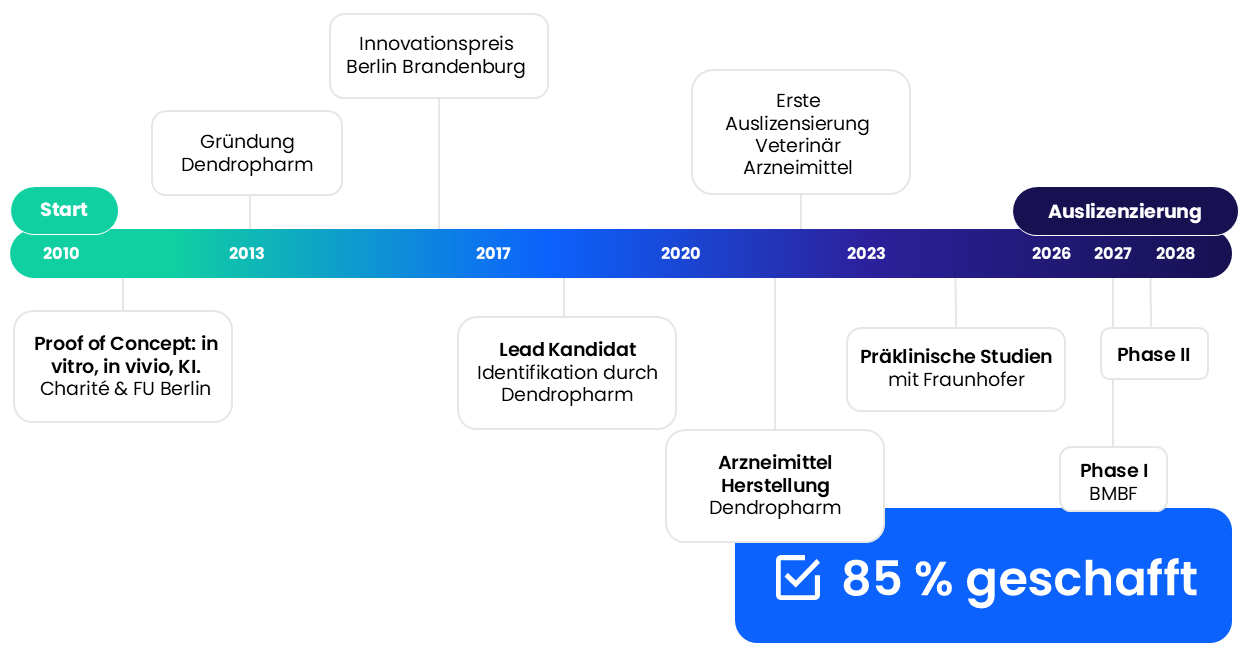
Wir haben das Projekt 2017 nach dem ersten Proof of Principle von der Freien Universität Berlin und Charité übernommen, die Entwicklungsdauer ist zu rund 85 % abgeschlossen. Als Generikum (bekannter Wirkstoff + innovativer Träger) ist der Zulassungsprozess deutlich schneller und einfacher.
Dendropharm verfügt über eigene Forschungs- und Produktionskapazitäten, einschließlich Reinraum und Anlagen zur Herstellung von Salben und Cremes, unter anderem für tiermedizinische Anwendungen. In diesem Segment haben wir bereits erste Kunden.
Durch Ihre Investition finanzieren wir die erste klinische Erprobung am Menschen (Phase I). 2027 planen wir nach einer weiteren Finanzierungsrunde die Erprobung am Patienten (Phase II). Im Anschluss streben wir für 2028 die Auslizenzierung an.
Ihr Investment schafft echten Mehrwert – und hilft, Menschen vor Opiatabhängigkeit und schweren Nebenwirkungen zu schützen.

Team

300 qm Reinräume und zur Herstellung von Arzneimitteln und Synthese von Nanomaterialien, 5 Analytik Labore plus Lager und Büros: Auf mehr als 650 qm Fläche entwickelt unser Team von 12 Personen innovative Medikamente. Ergänzt durch zwei Praktikanten arbeiten wir daran, dass 2026 bereits die erste Anwendung am Menschen erfolgt.
Dr. Sam Dylan Moré
Gründer und Geschäftsführer
Dr. Benjamin Kerscher
Leitung Herstellung
Olga Burlak
Leitung Qualitätskontrolllabor
Dr. Leo Sagurna
Forschung und Entwicklung
Sezin Üçbilek
Stellv. Leitung Fertigung
Produkt und Kundennutzen
Schmerzmittelinduzierte Abhängigkeit wird auch in Deutschland zunehmend zu einem ernsthaften Problem. In den USA wurde die Opiatkrise bereits als nationaler Notstand klassifiziert.
Unsere Technologie bietet eine wirksame Schmerzlinderung – ohne Suchtrisiko und ohne typische Nebenwirkungen wie Sedierung, Atemdepression oder Verstopfung. Das Medikament wird intravenös verabreicht (DENA-19) und kann auch in Schmerzpumpen eingesetzt werden.
Für postoperative Patienten, die aktiv am Leben teilnehmen möchten und kein Abhängigkeitsrisiko eingehen wollen, ebenso wie für Menschen, die während der Behandlung wach und ansprechbar bleiben müssen, stellt unser Produkt eine echte Alternative zu herkömmlichen Opiaten dar.
Die Vermeidung von Suchtpotenzial schafft einen großen gesellschaftlichen Mehrwert. Dies führt zu einer schnelleren Zulassung und einer höheren Akzeptanz bei Krankenkassen, da entsprechende Lösungen politisch und regulatorisch unterstützt werden.

Als Erweiterung des Portfolios sind geplant:
- Depotformulierung: eine Injektion bzw. Einbringung des Depot-Gels in die Operationswunde und 3- 7 Tage Analgesie.
- Nutzung des Targetings von Tumoren bei der Entwicklung von Krebstherapeutika.
Innovation und Technologie
Bei klassischen Opiaten gelangt das Schmerzmittel direkt in das Gehirn, was zu Suchterkrankungen und schwerwiegenden Nebenwirkungen führt. Bei der DendroPharm Nanotechnologie reichert sich ein sogenannter Nanocarrier direkt im entzündeten Gewebe oder Tumorgewebe an. Er ist zu groß, um die Blut-Hirn-Schranke zu überwinden und transportiert daher das Opiat ausschließlich direkt an den Ort, wo es gebraucht wird: Post-operatives Gewebe, Tumore, entzündetes Gewebe. Sucht entsteht im Gehirn. Unser Carrier verhindert, dass suchterzeugende Opiate das Gehirn erreichen.
Alle Patentrechte liegen bei uns: wir haben die Plattformtechnologie wesentlich weiterentwickelt und verschiedene Produkte designt. Als sogenanten Generika – einer Kombination aus einem bereits zugelassenen Wirkstoff verbunden mit einem innovativen Nanocarrier haben wir eine Platformtechnologie geschaffen, die einfacher und schneller zugelassen werden kann – bei vollen Patentschutz. Das Patent für die Plattformtechnologie ist bereits in der EU, in den USA und Kanada erteilt. Zwei neue Patente, die uns weltweiten Schutz bis 2045 geben werden, werden im Dezember 2025 eingereicht.
Zusätzlich gehören uns exklusiv alle Rechte am Zulassungsdossier.

Die Fraunhofer Gesellschaft, die für uns die Präklinischen Sicherheitsstudien sowie die Phase I durchführt, ist mit 2.5 % am Erlös beteiligt. Die Phase II Studie soll u.a. in Kooperation mit dem Fachbereich Schmerzforschung der Universitätsklinik in Jena durchgeführt werden.
Dendropharm wurde 2016 mit dem Innovationspreis Berlin Brandenburg ausgezeichnet. Das Projekt zur Entwicklung der NanoOpiate wurde 2020 aus mehr als 80 Konsortien vom Bundesministerium für Forschung, Technologie und Raumfahrt (BMBF/BMFTR) zur Förderung ausgewählt.
Markt und Zielgruppe
Die steigende Lebenserwartung führt zu einem Anstieg von Operationen – und zu einem erhöhten Bedarf an Schmerzmitteln. Dies ist der Markt, den unsere Kunden adressieren. Die negativen gesellschaftlichen Wirkungen von Opiatabhängigkeit (Stichwort Opiatkrise in den USA) treiben den Wunsch nach einem starken, nicht suchterzeugenden Schmerzmittel.
Diese Nachfrage adressieren wir mit unserer patentgeschützen Technologie: Dendropharm entwickelt ein intravenös zu gebendes Schmerzmittel (DENA-19). Dieses kann auch in Schmerzpumpen eingesetzt werden.
Weiterhin entwickeln wir – auch im Hinblick auf chronische Schmerzen – eine Depotlösung als Gel. Dieses Gel kann entweder direkt während der Operation platziert werden, oder als langzeit-wirkendes Präparat in den Körper gespritzt werden.
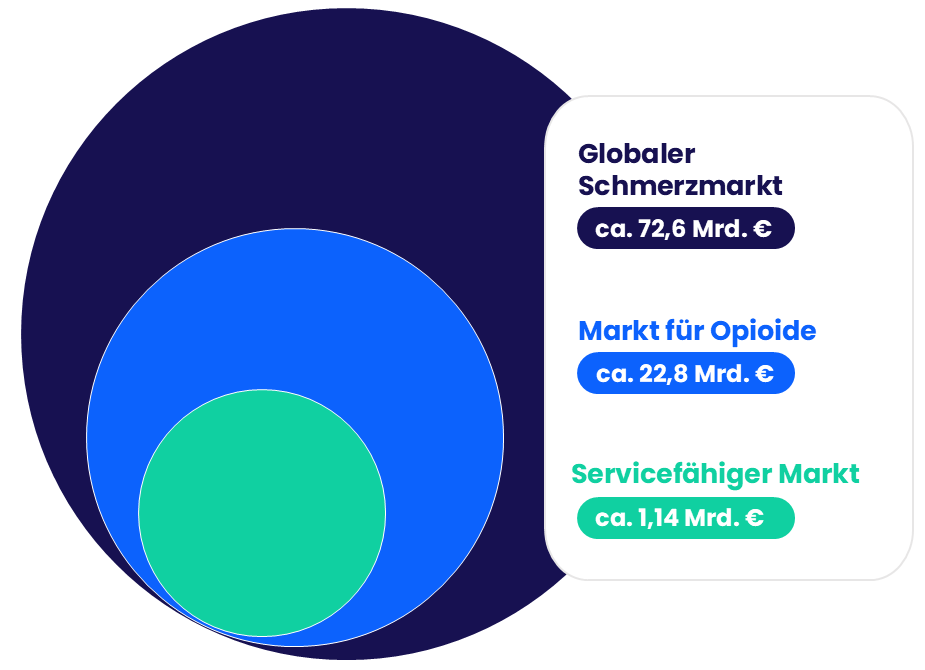
Unsere Kunden sind dabei die späteren Lizenznehmer unserer Technologie: große und mittlere Pharmafirmen weltweit. Die Erträge aus Pharmalizenzen bewegen sich über die Laufzeit des Patentes aktuell im unteren einstelligen Mrd. Bereich (EUR 1,2 - 1,8 Mrd.), davon werden 20-30 % in den ersten vier Jahren gezahlt.
Wettbewerb und Alleinstellungsmerkmale
Dendropharm setzt sich in einem Umfeld durch, in dem viele Schmerztherapie-Konzepte noch unsicher, sehr früh in der Entwicklung oder für andere Märkte gedacht sind. Unser Vorteil: Wir sind schneller und nutzen einen bereits zugelassenen Schmerzwirkstoff, den wir mit unserer Nanotechnologie gezielt im Körper verteilen. Dadurch kann unser Medikament bereits nach rund vier Jahren (direkt nach Phase II) auslizenziert werden – ein entscheidender Zeit- und Kostenvorteil gegenüber Wettbewerbern.
Unsere Technologie ist in den USA, Kanada und Europa bereits patentgeschützt; weitere weltweite Patente, inklusive China, sind in Vorbereitung und sichern mehr als 20 Jahre Schutz. Zusätzlich ermöglicht unsere Depotformulierung künftig auch eine wirksame und nebenwirkungsarme Behandlung mittelstarker chronischer Schmerzen.
Wir erfüllen wichtige Kundenbedürfnisse im Bereich des postoperativen Schmerzes, bieten schnelleren Marktzugang, hohe Sicherheit und präzise Dosierung. Ein Proof-of-Concept im Tiermodell bestätigt Wirksamkeit, Sicherheit und die passende Dosierung – ein weiterer Beleg für die Reife und Attraktivität unseres Ansatzes.


Geschäftsmodell und Vertrieb
Dendropharm erhält jährlich Fördermittel in Höhe von etwa EUR 200.000 bis 500.000. Die interne Forschung wird dabei zu rund 70–80 % durch öffentliche Gelder unterstützt.
Forschungsprojekte der akademischen Partnern (Charité Universitätskrankenhaus, Fraunhofer Gesellschaft, Universitäten) werden zu 100% gefördert und die Ergebnisse werden im Rahmen von Kooperationsverträgen Dendropharm zugänglich.
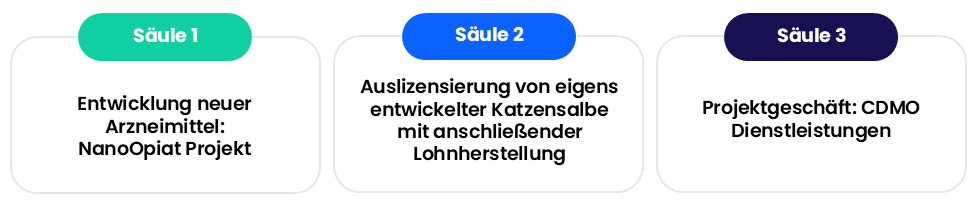
Dendropharm´s Geschäftsmodel beruht auf 3 Säulen:
1. Entwicklung neuer Arzneimittel: NanoOpiat Projekt
Wir entwickeln ein neues Arzneimittel in dem patentgeschützte Nanomaterialien mit bereits erprobten Wirkstoffen so kombiniert werden, dass ein innovatives ebenfalls patentgeschütztes Arzneimittel entsteht.
Humanarzneimittel wie das NanoOpiat werden bis zur ersten Erprobung am Menschen entwickelt. Im Anschluss erfolgt eine Auslizensierung. Diese erbringt Lizenzerträge von EUR 200 Mio. bis EUR 350 Mio. bei der initialen Auslizensierung (zwischen 2028 und 2031. Globale Auslizensierungen generieren typischerweise über die gesamte Patentlaufzeit EUR 1,2 – 1,8 Mrd. an Einnahmen.
Das Humanarzneimittel wird dabei vom Lizenznehmer produziert und vertrieben, wir erhalten das Geld für die Bereitstellung der Unterlagen die für die Zulassung notwendig sind sowie für die Patentrechte.
2. Auslizensierung von eigens entwickelter Katzensalbe mit anschließender Lohnherstellung
Für den Veterinärbereich haben wir ein Arzneimittel entwickelt, das an einen Vertriebspartner lizensiert wird, der im Anschluss die bei uns produzierten Arzneimittel erwirbt und auf eigene Rechnung vertreibt.
Die Katzensalbe wurde 2021 auslizensiert und wird 2026 zugelassen. Ab dem nächsten Jahr erwarten wir kontinuierliche Einnahmen.
3. Projektgeschäft: CDMO Dienstleistungen
Um unsere Labore, Herstellräume und insbesondere den strategischen Vorteil einer GMP Herstellerlaubnis zu nutzen, bieten wir Kunden aus Start-ups und Mittelstand sowie akademischen Forschungsgruppen folgende Projektdienstleistungen an:
- Entwicklung von neuen Arzneimitteln und Kosmetika
- Synthese von Wirkstoffen
- Analytikdienstleistungen wie transdermale Hautpenetrationstests, Forschungskits, Stabilitätstest von Arzneimitteln
- Herstellung von Kleinchargen (ab 2026)
Aktuell haben wir Kundenanfragen in der Größenordnung von EUR 600.000 für 2026 erhalten.
Als Vertriebskanäle nutzen wir Partnering Meetings und Messekontakte. Zugang zu akademischen Kunden erhalten wir durch bestehende Kooperationen mit Universitäten.


Kooperationen entstehen vor allem durch bestehende Netzwerke, Konferenzen und Partnertreffen. Dendropharm behält die vollen Rechte an geistigem Eigentum (Patente, Know-how), während die Partner abhängig vom Projekt und Umsatz beteiligt werden.
Aktuelle Partner sind unter anderem:
- TU Berlin
- FU Berlin (Organische Chemie, Veterinärmedizin)
- Fraunhofer-Gesellschaft (ITEM, IZI)
- Charité Berlin
- Universitäten in Halle, Leipzig, Potsdam, Gent und Wien (BoKu)
Bisherige Erfolge
Erfolgreiche Arzneimittelentwicklungen und erste Kundenbasis
- bereits 6 Kunden aus mittelständischen Unternehmen, KMU, Forschungsinstituten und start-ups für Entwicklungen von neuen Arzneimitteln
- bereits 4 Kunden aus dem Forschungsbereich zur Synthese von unseren innovativen Nanomaterialien
- Entwicklung eines eigenen Veterinärarzneimittels und erfolgreiche Auslizensierung an Partner für weltweiten Vertrieb: Mit unserer Katzensalbe, basierend auf unserer transdermalen Technologie, konnten wir die Sterblichkeit von Katzen mit Schilddrüsenüberfunktion um 70% gegenüber herkömmlichen Tabletten senken. Dafür haben wir 2016 den Innovationspreis Berlin-Brandenburg gewonnen. Der Markteintritt ist für 2026 anvisiert.
Die wichtigsten Preise, die wir bekommen haben
- Businessplanwettbewerb 2014 – 2. Platz
- Preisträger Innovationspreis Berlin Brandenburg 2016
- Unter die 5 weltweit wichtigsten high-impact Nanotech Startups gewählt 2019 durch die Business Analyst Platform startus insights
- September 2021 - ZGC Forum "100 Best Innovation Technology for International Transactions"
Etablierung eines modernen Qualitätsmanagementsystems
Voraussetzung für Kundenaufträge und Zulassung von Arzneimitteln aus unserer Herstellung
- Zertifizierung nach ISO 9001 seit 2015.
- Zertifizierung nach GMP im Jahr 2022 durch das Lageso. Dies ist der international anerkannte Pharmastandard für unser Labor, der uns berechtigt zulassungsrelevante Arzneimittelanalytik zu betreiben.
- Erfolgreich absolvierte Inspektion zur pharmazeutischen Herstellerlaubnis: September 2025.
Mit dieser Basis können wir ab 2026 unseren Umsatz signifikant steigern, in dem wir zusätzlich zur Entwicklung auch die Herstellung klinischer Prüfmuster sowie die Abfüllung von Kleinchargen von Arzneimitteln und Kosmetika anbieten.
Ziele und Kapitalverwendung
Roadmap:
- Start Phase I im 3. Quartal 2026
- Start Phase II (Verifizierung der wirksamen Dosis beim Patienten im 3. Quartal 2027
- Start Phase II für das Depotpräparat in 2029
- Auslizensierung zwischen 2028 und 2031
Die im Rahmen der aktuellen Finanzierungsrunde eingeworbenen Mittel werden gezielt eingesetzt, um die Auslizenzierung der Nano-Pain-Technologie voranzutreiben.
Ein wesentlicher Teil des Kapitals fließt in den Ausbau von Forschung und Entwicklung. Dazu gehören die Einstellung zusätzlicher Fachkräfte, die Weiterbeschäftigung des bestehenden Teams sowie die Beschaffung notwendiger Materialien und Laborressourcen.
Darüber hinaus wird die Produktpipeline erweitert, um neue Anwendungsmöglichkeiten der Technologie zu erschließen. Ein Teil der Mittel wird außerdem für die Finanzierung eines „Fast-Track“-Zulassungsverfahrens in den USA verwendet, um die Markteinführung zu beschleunigen.
Durch diese Maßnahmen wird die Basis geschaffen, die Nano-Pain-Technologie effizient in die nächste Entwicklungs- und Kommerzialisierungsphase zu führen.
Top Gründe für eine Investition
1. Hoher medizinischer Bedarf
Unser Produkt adressiert ein weltweit existierendes, dringendes medizinisches Problem: chronische und akute Schmerzen. Millionen von Menschen könnten von einer effektiven, nicht-suchterzeugenden Schmerztherapie profitieren, wodurch wir einen direkten gesellschaftlichen und gesundheitlichen Impact erzielen.
2. Führend in der Schmerzmittel-Entwicklung
Dendropharm gehört zu den Top Unternehmen weltweit, die an einem peripher wirksamen Schmerzmittel arbeiten. Damit positionieren wir uns in einem hochinnovativen Markt mit starker Wachstums- und Differenzierungsperspektive.
3. Fortgeschrittener Entwicklungsstand
Wir haben bereits 85 % des Weges zur Auslizenzierung unserer Plattformtechnologie zurückgelegt. Investoren profitieren dadurch von geringem Entwicklungsrisiko und einem klaren Fahrplan zur Markteinführung.
4. Attraktiver Zeitpunkt für Investitionen
Nach Abschluss der Phase-I-Studie steigt der Unternehmenswert üblicherweise signifikant an. Eine Investition jetzt bietet die Möglichkeit, gemeinsam einen spürbaren Impact zu generieren – sowohl für Dendropharm als auch für die Investoren.

Risikomanagement
- Managementrisiko: gemindert durch klare regulatorische Vorgaben, ein erfahrenes Entwicklungsteam und starke Partnerschaften mit Forschungspartnern und Kunden;
- Technische Risiken: gemindert durch Proof-of-concept welches umfangreich in Kooperation mit dem Entwicklungspartner Charité im Tiermodel bestätigt wurde.
- Regulatorische Risiken: Der Weg bis hin zur Phase II ist regulatorisch klar vorgezeichnet. Wir haben bereits mit relevanten Zulassungsbehörden Kontakt und lassen und zusätzlich von einem Beratungsunternehmen mit Erfahrung mit Nanomaterialien beraten.
- Finanzielles Risiko: Projektverzögerungen können wir durch Umsatzgeschäft auffangen. Dieses bauen wir kontinuierlich mit dem Ziel aus, alle laufenden Kosten aus Umsätzen zu decken. Damit können wir starke Verwässerungen vermeiden. Parallel werben wir über eine VC Finanzierungsrunde Gelder in der Größenordnung von EUR 3 - 6 Mio. ein, um im Jahr 2027 die Phase II durchführen zu können.
- Know-How Verlust:
- Dokumentation aller Forschungsdaten in einer gesicherten Cloud Datenbank, die kontinuierlich befüllt wird (Elektronisches Laborjournal)
- Dokumentation aller Zulassungsdaten und Hestellungsverfahren auf einem externen gesicherten Server
- Aufrechterhaltung hoher und extern zertifizierter Qualitätsstandards in Planung, Durchführung und Dokumentation, die nach ISO 9001 die durch den TUEV SUED jährlich überprüft werden
- Die Einhaltung der Pharmastandards für die Herstellung und für die Durchführung unserer Analytik wird weiterhin genauestens durch das Lageso (entspricht dem Regierungspräsidium) geprüft
Über Dendropharm
Dendropharm wurde 2013 gegründet – nach zwei Jahren intensiver Vorbereitung, in denen das Startkapital sowie rund Fördermittel eingeworben wurden. Gegründet wurde das Unternehmen von Dr. Sam Moré als berufserfahrenem Chemiker mit 10 Jahren Hintergrund in der Forschung von Nano-Materialien und 8 Jahren Erfahrung im Bereich Gründung von Startups sowie Dr. Henrik Lüssen, Experte für Business Development Pharma, Dr. Margret Moré, Expertin für Pharma Zulassungen gemeinsam mit 2 Post-docs aus der Arbeitsgruppe von Prof. Haag.
Der Auslöser für die Gründung war der Wunsch, pharmazeutisches Know-how sinnvoll einzusetzen und ein Arbeitsumfeld zu schaffen, in dem Menschen unterschiedlicher Herkunft gemeinsam an einem Ziel arbeiten: Arzneimittel mit weniger Nebenwirkungen zu entwickeln. Ein zentraler Teil der Vision ist es, alle Mitarbeitenden am Erfolg des Unternehmens zu beteiligen und ein wertschätzendes, kooperatives Miteinander zu leben.
Bis 2027 verfolgt Dendropharm das Ziel, sich finanziell selbst zu tragen und kontinuierlich zu wachsen.
Zwischen 2028 und 2030 strebt Dendropharm den Transfer der gemeinsam entwickelten Produkte in die klinische Anwendung an, damit sie endlich den Patientinnen und Patienten zugutekommen.

FAQ
Was passiert, wenn die präklinische Entwicklung nicht erfolgreich ist?
Das würde zu einer Erhöhung der Kosten um max. EUR 800.000 führen, denn dann müsste die Formulierung des Depotpräparats auf postoperative Anwendungen angepasst werden.
Was unterscheidet Dendropharms Technologie von herkömmlichen Schmerzmitteln?
Bei der Dendropharm Nanotechnologie reichert sich ein sogenannter Nanocarrier direkt im entzündeten Gewebe oder Tumorgewebe an. Er ist zu groß um die Blut-Hirn-Schranke zu überwinden und transportiert daher das Opiat direkt an den Ort, wo es wehtut: Post-operatives Gewebe, Tumore, entzündetes Gewebe. Sucht entsteht im Gehirn. Unser Carrier verhindert, dass suchterzeugende Opiate das Gehirn erreichen.
Kann die Technologie auch in der Krebsforschung eingesetzt werden, da ja Tumore getargeted werden?
Ja das ist möglich. Dendropharm hat Forschungskooperationen mit der Charité Universitätsklinik der Freien Universität Berlin sowie mit der Fraunhofer Gesellschaft, bei denen beforscht wird, wie unsere Nanocarrier am besten in der Krebsbehandlung eingesetzt werden können.
Due Diligence Datenraum
Hier können Sie Zugriff auf den Due Diligence Datenraum des Unternehmens anfragen.
Für die Freigabe ist es erforderlich, dass Sie sich auf der FunderNation Plattform identifizieren. Die Identifikation können Sie hier durchführen.
Ihre Anfrage leiten wir an das Unternehmen weiter. Wird der Zugang bestätigt, erhalten Sie ein NDA zur Unterzeichnung. Nach unterschriebenem NDA stellen wir Ihnen den Zugang zum Datenraum zur Verfügung. Wird der Zugang abgelehnt, sollten Sie dies in Ihrer Investitionsentscheidung berücksichtigen.






Individuelle Berechnung Ihrer Rendite auf Basis der Finanzplanung und Ihres Investitionsbetrags – inklusive transparenter Zinsgrafik zur Darstellung der Auszahlung über die gesamte Laufzeit:
Rendite individuell berechnen